Чума по имени Эбола

 Из четырех всадников Апокалипсиса у нас сегодня налицо два – война и смерть пришли в Европу, и украинские события не оставляют в этом никакого сомнения. Но, словно мало этого горя, появился и третий всадник – чума, как в средневековье называли любую смертельную массовую болезнь. Вирус Эбола, вызывающий одноименную смертельную лихорадку, «проснувшись» в Западной Африке, начал свое шествие по планете. Уже в Нью-Йорке госпитализирован мужчина с симптомами смертельно опасной болезни. Случаи болезни отмечаются и на других континентах. Среди африканцев бродят панические слухи, что это – дело рук белых, вырастивших в своих лабораториях новую чуму, чтобы уменьшить черное население. ООН, ВОЗ бьют тревогу, на борьбу с эпидемией срочно выделили 200 млн. долларов, врачи предпринимают отчаянные усилия, чтобы локализовать очаг эпидемии. Получится ли это у них — никто не знает. Вакцины от смертельной лихорадки не существует и все усилия ученых по ее разработке пока остаются тщетными.Чтобы понять, насколько этот вирус опасен, можно привести такую аналогию: это как СПИД, только еще более заразный. Эбола — один из самых опасных вирусов на земле. Коэффициент смертности от него доходит до 90%. Источником считаются дикие животные, но вирус передается и между людьми практически всеми возможными путями: через кровь, физиологические жидкости, рукопожатие и просто воздушно-капельным путем.Несмотря на всю угрозу, исходящую от вируса, население стран о нем мало что знает. Мы решили восполнить этот недостаток и поэтому публикуем сегодня отрывок из монографии одного из самых известных и авторитетных российских микробиологов (кстати – бывшего казахстанца!) Михаила Васильевича Супотницкого. Несмотря на научный характер его труда, любому читателю станет ясно: мы имеем дело с очень опасным природным процессом, который вполне может перерасти в эпидемию мирового масштаба.
Из четырех всадников Апокалипсиса у нас сегодня налицо два – война и смерть пришли в Европу, и украинские события не оставляют в этом никакого сомнения. Но, словно мало этого горя, появился и третий всадник – чума, как в средневековье называли любую смертельную массовую болезнь. Вирус Эбола, вызывающий одноименную смертельную лихорадку, «проснувшись» в Западной Африке, начал свое шествие по планете. Уже в Нью-Йорке госпитализирован мужчина с симптомами смертельно опасной болезни. Случаи болезни отмечаются и на других континентах. Среди африканцев бродят панические слухи, что это – дело рук белых, вырастивших в своих лабораториях новую чуму, чтобы уменьшить черное население. ООН, ВОЗ бьют тревогу, на борьбу с эпидемией срочно выделили 200 млн. долларов, врачи предпринимают отчаянные усилия, чтобы локализовать очаг эпидемии. Получится ли это у них — никто не знает. Вакцины от смертельной лихорадки не существует и все усилия ученых по ее разработке пока остаются тщетными.Чтобы понять, насколько этот вирус опасен, можно привести такую аналогию: это как СПИД, только еще более заразный. Эбола — один из самых опасных вирусов на земле. Коэффициент смертности от него доходит до 90%. Источником считаются дикие животные, но вирус передается и между людьми практически всеми возможными путями: через кровь, физиологические жидкости, рукопожатие и просто воздушно-капельным путем.Несмотря на всю угрозу, исходящую от вируса, население стран о нем мало что знает. Мы решили восполнить этот недостаток и поэтому публикуем сегодня отрывок из монографии одного из самых известных и авторитетных российских микробиологов (кстати – бывшего казахстанца!) Михаила Васильевича Супотницкого. Несмотря на научный характер его труда, любому читателю станет ясно: мы имеем дело с очень опасным природным процессом, который вполне может перерасти в эпидемию мирового масштаба.
Семейство вирусов Filoviridae, вирусы Эбола и Марбург. Семейство вирусов известно с 1967 г., когда ранее неизвестный вирус вызвал вспышку геморрагической лихорадки в Марбурге (ФРГ) среди работников предприятия по производству вакцин, ассоциированную с контактным заражением от приматов, привезенных из Уганды. Филовирусы являются членами порядка Mononegavirales. Их название происходит от лат. filum (нить), отражающего их уникальную нитчатую морфологию. Семейство Filoviridae включает только один род, Filovirus, состоящий из двух видов — вирусы Эбола и Марбург. Эти виды имеют сходную геномную организацию, но в значительной степени отличаются друг от друга по нуклеотидной последовательности и лишены антигенной перекрестной реактивности. Вирус Эбола имеет не менее шести субтипов (Zaire, Sudan, Cote d’Ivoire, Bundibugyo, Lloviu и Reston). У вируса Марбург (Lake Victoria) субтипы не известны, но выделены от больных людей и животных, как минимум, девять генетически отличающихся изолятов (Ci6777, Popp, Musoke, Ravn, Angola и др.). Наиболее вирулентным для человека среди субтипов вируса Эбола является Zaire, среди изолятов вируса Марбург — Angola. Основываясь на сопоставлении летальных исходов среди заболевших людей, D. A. Alves et al. (2010) 1 считают изолят Angola вируса Марбург более вирулентным для людей, чем субтип Zaire вируса Эбола.
Большинство случаев филовирусной инфекции распознается только в условиях больших вспышек и при наличии эпидемической настороженности у врачей. Еще несколько лет назад считалось, что филовирусы циркулируют в прилегающих с юга к Сахаре странах Африки, вызывая масштабные вспышки тяжелых форм геморрагических лихорадок; и на Филиппинах, где обнаружен не опасный для человека субтип Reston вируса Эбола .

Однако Филиппинами и Юго-Восточной Азией географическое распространение филовирусов не ограничивается. В трупах летучих мышей Miniopterus schreibersii (обыкновенный длиннокрыл), собранных в одной из пещер в испанской провинции Астурия, обнаружен новый филовирус, названный Lloviu ( Lloviu virus , LLOV). Название вируса происходит от названия пещеры Cueva del Lloviu. Вирус выделен из пневмонических очагов в легких М. schreibersii. Хотя пещеру часто посещают люди, случаев болезни, вызванных вирусом Lloviu, у них не выявлено. Это второй известный филовирус, не опасный для людей. Филогенетический анализ указывает на существование в прошлом общего предка всех филовирусов, от которого Lloviu отделился, по крайней мере, 150 тыс. лет назад (Negredo A. et al., 2011). Возможно обнаружение других очагов филовирусов на европейском континенте.
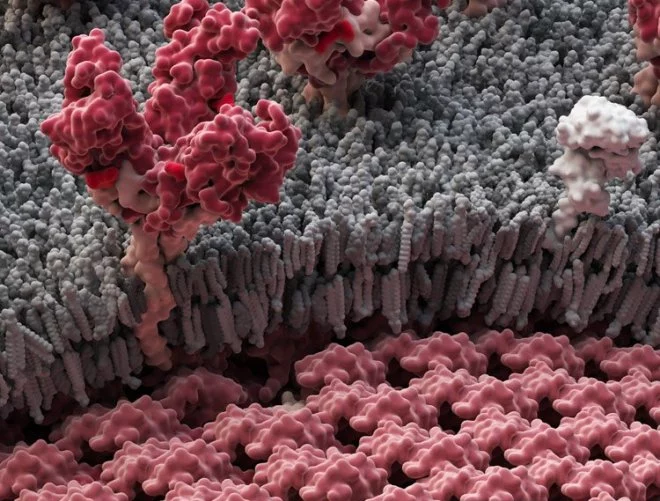
На электронных микрофотографиях филовирусные вирионы представляют собой длинные нити. Длина вирусных частиц варьирует в пределах от 800 до 1400 нм, но они имеют постоянный диаметр, равный 80 нм. Филовирусы — относительно простые вирусы, имеющие геном 19 т. п. о., кодирующий, по меньшей мере, 8 белков: нуклео-протеид (NP), вирионные белки (VP35, VP40, VP30 и VP24), белок с полимеразной активностью (L), трансмембранный гликопротеид (GP) и растворимый гликопротеид (sGP). Все гены расположились в одной цепи отрицательной-смысловой РНК.
Tengp кодирует оба гликопротеида и является самым вариабельным участком генома вируса Эбола. Доминирующим продуктом гена является гликопротеид sGP. Синтез GP происходит в результате корректировки РНК. Белки Np30, VP30, VP35 и L объединяются с вирусной геномной РНК, образуя рибонуклеопротеидный комплекс (центральный рибонуклеопротеидный кор), тогда как белки VP40, VP24 и GP ассоциируются с вирусной мембраной (Warfield К. L. et al., 2006; Melito P. L. et al., 2008). Белок VP35 вируса Эбола (Zaire) функционирует аналогично белку NS1 вируса гриппа, препятствующего индукции интерферона типа I в инфицированных клетках. Белок VP35 может действовать путем связывания с двунитевой РНК, препятствуя таким образом активации днРНК-ассоциированной фосфокиназы и, возможно, других антивирусных белков.
Линейное расположение вирусных генов напоминает таковое у рабдо- и парамик-совирусов. 3′- и 5′-концы генома содержат консервативные, комплементарные последовательности, которые являются важными цис -действующими регуляторами геномной репликации, транскрипции и, возможно, упаковки вирусной частицы. Транскрипция отдельных генов регулируется некодирующими участками на 3′- и 5′-концах, содержащих короткие консервативные последовательности (Bray М., Paragas J., 2002).
Цикл репликации у филовирусов похож на таковой у хорошо изученных рабдо- и парамиксовирусов. Репликация начинается с прикрепления вириона к рецептору на поверхности клетки (предположительно а-фолатный рецептор). После связывания с рецептором вирус проникает в клетку путем рецептор-опосредованного эндоцитоза. В результате слияния вирусной оболочки с мембраной эндосомы, центральный рибонуклеопротеидный кор высвобождается в цитоплазму. Транскрипция начинается на З’-конце генома посредством вирусной РНК-зависимой РНК-полимеразы и приводит к синтезу лидерной РНК и семи полиаденилированных мРНК. Аккумуляция первых двух белков, кодируемых на З’-конце генома (NP и VP35), каким-то образом стимулирует продуцирование положительно-смысловых «антигеномов» полной длины, которые, в свою очередь служат в качестве матриц для синтеза генома. Вирион состоит из центрального рибонуклеопротеидного кора, связанного с двумя матричными белками, VP24 и VP40, покрытого двойным липидным слоем, содержащим гликопротеид, полученным от клетки-хозяина. Гликопротеид образует на поверхности вириона тримерные шипы (Bray М., Paragas J., 2002).
В случае вируса Эбола, но не вируса Марбург, первичный продукт, кодируемый геном gp , является усеченным белком, лишенным С-терминального гидрофобного мембранного якоря. Этот «растворимый GP» (sGP) высвобождается из инфицированных клеток. Синтез GP вируса Эбола полной длины требует вставки дополнительного аденозина в «редактирующем сайте» в процессе транскрипции. Во время прохождения через аппарат Гольджи, GP обильно гликозилируется и расщепляется клеточным фуриноподобным ферментом на две единицы: внеклеточный GF l и трансмембранный GP 2 , которые остаются связанными дисульфидной связью в виде GP} 2 . Сборка новых вирусных частиц происходит на внутренней поверхности плазматической мембраны, где VP24 и VP40 связываются, по-видимому, не только с новым центральным рибонуклеопротеидным кором, но и с цитоплазматическим хвостом GP 2 . Полный цикл репликации длится примерно 12 ч.
Вирусы Эбола и Марбург происходят от одного предка. Несинонимические замены в гене gp вирусов Эбола и Марбург оцениваются как 3,6х 10 -5 на сайт/год (per site per year). Что в сотни раз медленнее, чем у ВИЧ или у вируса гриппа, но примерно соответствует скорости несинонимических замен у вируса гепатита В, имеющего ДНК-геном. Дивергенция вирусов Эбола и Марбург произошла тысячи лет назад (Suzuki Y., Gojobori Т., 1997).
Первичный природный резервуар филовирусов неизвестен. В течение длительного времени считалось, что подобно некоторым другим классическим вирусным зоонозам, вирусы Эбола и Марбург поддерживаются у некоторых видов позвоночных в виде хронической/персистирующей инфекции, которая не вызывает заболевание. Причем и вид-резервуар, и вирус сохраняются в течение достаточного периода времени, чтобы обеспечить передачу другим восприимчивым хозяевам. Предполагалось, что резервуарами являются многие виды позвоночных, включая летучих мышей, мышей, землероек и других, живущих на земле животных, но, несмотря на интенсивный поиск, было обнаружено, что ни одно из них не продуцировало живые вирусы в естественных условиях. Хотя вспышки лихорадок Эбола и Марбург часто ассоциировались с контактами с низшими приматами, но эти виды не являются природными резервуарами фило-вирусов, поскольку и у них наблюдается высокая летальность при заражении. Местное население мало чем способно помочь исследователям при установлении эпидемических цепочек филовирусов. Традиционные поверья, распространенные в Центральной Африке, связывают болезнь с колдовством или отравлением, но не с вирусом.
После вспышек лихорадки Эбола в 1994 г. в республике Кот-д’Ивуар и в 1995 г. в Демократической Республике Конго, были предприняты интенсивные попытки идентифицировать природные резервуары филовирусов. Однако они не дали ответа на вопрос, кто из животных или растений является первичным резервуаром 2 . Некоторые ученые по-прежнему настаивают на том, что резервуаром, из которого происходит инфицирование людей, являются летучие мыши. J. S. Towner et al. (2009) приводят доказательства длительного поддержания вируса Марбург в колониях египетских фруктовых летучих мышей (Rousettus aegyptiacus ).
До настоящего времени не идентифицированы членистоногие-переносчики, и какие-либо другие механизмы передачи филовирусов из природного резервуара людям и низшим приматам. Неясными остаются механизмы, лежащие в основе высокой чувствительности людей и низших приматов к вирусам Эбола и Марбург дикого типа по сравнению с другими видами (т. е. мышами и, возможно, летучими мышами).
Эксперименты на приматах показали, что животные заболевают после интрана-зального, перорального и конъюнктивального ведения вирусов Марбург и Эбола. У людей такой путь занесения инфекции в организм возможен, но прямые доказательства отсутствуют, полученные в очагах болезни, отсутствуют. Воздушно-капельный путь заражения скорее исключение, чем правило. В природе, судя по патологоанатомической картине болезни у погибших животных, вирус передается через пищу. У них нет поражений альвеол и бронхов, в основном в патологический процесс вовлечены кишечные лимфатические узлы, печень и селезенка (Wyers М. et al., 1999).
Больные лихорадками Эбола и Марбург очень опасны для медицинского персонала. Например, в 2000 г. во время вспышки лихорадки Эбола в Уганде (погибло 224 человека) из 22 человек медицинского персонала заболело 14 (64 %). Первичными больными с филовирусной инфекцией чаще всего были мужчины, которые работали в лесах, котлованах или рудниках. Вирусы лихорадок Эбола и Марбург могут в течение 101 сут и 83 сут, соответственно, выделяться с семенной жидкостью реконва-лесцентов. Доказаны случаи полового заражения этими вирусами (Borio L. et al., 2002; Peterson A. T. et al. 2004).
Циркуляция вируса Эбола среди населения Габона серологически показана еще в 1982 г. В 1994—1994 гг. были зарегистрированы три независимые друг от друга вспышки геморрагической лихорадки Эбола у людей в северо-восточной части Габона, в районе лесов экваториальной провинции Огуо-Ивиндо. Каждая вспышка сопровождалась гибелью приматов. Первая из них началась в декабре 1994 г. в сезон дождей (декабрь и февраль) в лагере золотодобытчиков на северо-востоке Габона в районе Minkouka между Г24″ и Г44″ с. ш. и 12 / 59 // в. д. около реки Нуна. Вторая — в начале февраля 1996 г. в селении Mayibout (ГОУ» с. ш. и 13’06» в. д.) около реки Ивиндо (37 случаев болезни). Наиболее близкий к ним город Makokou, расположенный в О’ЗЗ» с. ш. и 12’50» в. д., имел свой госпиталь, куда доставлялись больные и контактировавшие с ними жители. Третья всп ышк а началась в июле 1996 г. в поселке Вооиё (О’Об» ю. ш. и 1Г57″ в. д.), где выявлено большинство заболевших. Также были диагностированы отдельные случаи болезни в близлежащих городах и поселках. Всего за время третьей вспышки зарегистрировано не менее 43 летальных случаев геморрагической лихорадки Эбола.
Вирус Эбола легко выделялся из крови людей в культуре клеток Vero Е6 при единственном пассаже. У вирусов, выделенных от больных, определялась последовательность гена gp. Филогенетический анализ выявил общее эволюционное происхождение вирусов, вызвавших вспышки в Габоне и Заире. Кроме того, полученные данные подтвердили независимость друг от друга трех вспышек в Габоне. Ген gp вирусов, выделенных во время весенней вспышки 1996 г. в Габоне, отличался от последовательности гена gp вирусов вспышки конца 1994 г. четырьмя дополнительными нуклеотидами. Между вирусными последовательностями, полученными непосредственно из клинического материала и путем пассирования в тканевой культуре, или между последовательностями от первичных и вторичных случаев заболевания, различий не было. Наличие постоянных вирусных последовательностей и отсутствие генетического разнообразия между штаммами, выделенными в пределах отдельной вспышки, было показано в 1995 г. во время вспышки геморрагичекой лихорадки Эбола в селении Киквит (Заир) и подтверждено в Габоне.
Полученные М. С. Georges-Courbot М. С. et al. (1997) данные показали, что вирусы, вызвавшие вспышки лихорадки Эбола на разных эндемичных территориях, отличаются друг от друга по нуклеотидным последовательностям гена gp, однако генетического разнообразия между штаммами, выделенными в пределах отдельной вспышки обычно не наблюдается. Возможны вспышки, вызванные рекомбинантами, образовавшимися в пределах одного субтипа вируса Эбола (Wittmann Т. J. et al., 2007).
Из книги «Биологическая война. Введение в эпидемиологию искусственных эпидемических процессов и биологических поражений». Публикуется с сокращениями
Примечание от редакции: О том, как оценивают эту угрозу санитарные власти Казахстана, предпринимают ли какие-то меры против этой опасности и считают ли вообще угрозу эпидемии смертельной лихорадки реальной — на сегодня ничего не известно…
А между тем на днях Всемирная организация здравоохранения объявила, что распространение вируса Эбола в Западной Африке представляет собой угрозу международного значения. Эксперты пришли к выводу, что «вспышка Эболы в Западной Африке является «чрезвычайным событием» и представляет угрозу общественному здравоохранению других государств».
Как уточняет ИТАР-ТАСС со ссылкой на данные специалистов, возможные последствия дальнейшего распространения особенно серьезны, учитывая вирулентность вируса, способы его передачи, а также слабую систему здравоохранения в затронутых проблемой странах.
Согласно последней статистике ВОЗ, число жертв вспышки лихорадки Эбола с февраля текущего года достигло 932 человек, заразились 1711. Больше всего людей погибло в Гвинее, Либерии и Сьерра-Леоне. Смертельный случай также зафиксирован в Нигерии.







Все комментарии проходят предварительную модерацию редакцией и появляются не сразу.